中絶薬
中絶薬について
世界では30年以上前から使用されていますが、日本では今年4月に初めて承認されしようできるようになりました。
日本では厚生労働省の個人輸入規制対象薬物であり、インターネットでの個人輸入は禁止されています。個人での使用は堕胎罪(刑法212条「妊娠中の女子が薬物を用い、またはその他の方法により堕胎したときは1年以下の懲役に処する」)が適用されます。
中絶を悩まれている方には、いろいろな事情があるかと思います。忙しくて通院できない人、経済的な余裕がない人、パートナーと連絡がとれない人、人には相談できない事情がある人。精神的な負担だけではなく、妊娠という身体の変化にも悩まされていることでしょう。
中絶薬による中絶を希望される場合は、中絶薬の使用が許可された母体保護法指定医師のいる医療機関で相談してください。
日本で承認された中絶薬について
中絶薬は2つの薬剤、ミフェプリストンとミソプロストールから成ります。それぞれの薬剤の役割は以下の通りです。
- ミフェプリストン:妊娠維持に必要なプロゲステロンの働きをブロックする薬
- ミソプロストール:子宮の入り口を開き、子宮収縮(陣痛)をおこす薬
上記2剤の併用が推奨されつつありますが、薬剤の使用方法は数パターン存在しています。
日本での中絶薬の適応と使用方法等
適応
妊娠63日(9週0日)以下
内服方法
ミフェプリストン錠200㎎経口投与の36~48時間後にミソプロストールバッカル錠800μg口腔内投与する
使用できない人
- 本剤に対してアレルギーがある
- ポルフィリン症
- ステロイド剤の吸入又は内服している
- 出血性疾患
- 抗凝固剤を内服している
- 抗血小板薬を内服している
- CYP3A誘導剤を内服している
- 重度の肝機能障害
- 重度の貧血(血中ヘモグロビン値7g/dL以下)
- 子宮内避妊具を使用中(抜去すれば中絶薬使用可)
※CYP3A誘導剤:リファンピシン、リファブチン、カルバマゼピン、フェニトイン、セイヨウオトギリソウ、フェノバルビタール、ボセンタン、エファビレンツ、ダブラフェニブ、エトラビリン、ロルラチニブ、プリミドン、ソトラシブ
注意事項
- 指定された医療機関で処方をうけること(ラインファーマのホームページに掲載)
- 内服後の腹痛、出血があり、鎮痛剤でも治まらないような痛み、または夜用ナプキンを1時間に2回以上交換するような出血が2時間以上続く場合は、かかりつけに連絡すること
- 発熱など感染症を疑う症状があるときはかかりつけに連絡すること
- 医師の許可が出るまで、出血に伴う失神の可能性も考慮して、自動車・バイク・自転車などの運転を控える
- 中絶薬を内服した後に、中絶を中断する決定をした場合、薬剤による胎児の先天異常の可能性がある
- 中絶薬を内服しても、状況によっては手術が必要になることがある
中絶成功率
| 1剤目経口投与後 | 1.7% |
|---|---|
| 2剤目バッカル投与後 | 4時間まで 61.7% |
| 4~8時間 26.7% |
|
| 8~12時間 1.7% |
|
| 20~24時間 1.7% |
当院では中絶手術と中絶薬で悩まれている方のカウンセリングを行っております
中絶薬が日本で承認されましたが、使用実績はまだ少なく、ネットにも間違った情報があふれています。当院では中絶薬、中絶手術両方の実績があるため、どのような副作用があるか比較しながらご説明いたします。。
10分の「手術」と8時間待つ「飲み薬」 医会が経口中絶薬の導入に消極的な事情料金について
30分 11,000円
中絶薬の種類と使用方法
- ミフェプリストン:妊娠維持に必要なプロゲステロンの働きをブロックする薬
- ミソプロストール:子宮の入り口を開き、子宮収縮(陣痛)をおこす薬
上記2剤の併用が推奨されつつありますが、薬剤の使用方法は数パターン存在(投与量や投与のタイミング)していて、どのレシピが最優良かの決着はついていません。
FDA 2016年
最終月経の初日から70日以内の妊娠に対して使用可能
ミフェプリストン内服(200 ㎎)の24~48 時間後に
ミソプロストール(800μg)を投与
WHOの推奨投与法
妊娠7週まで
ミフェプリストン内服(200 ㎎を推奨)の24~48 時間後に
ミソプロストールを腟内・頬側・舌下投与(800μg を推奨)または内服(400μg を推奨)
妊娠7~9 週
ミフェプリストン内服(200 ㎎を推奨)の24~48 時間後に
ミソプロストールを腟内・頬側・舌下投与(800μg を推奨) 内服投与は不可
妊娠9~12 週
ミフェプリストン200㎎内服の36~48 時間後に
ミソプロストール800μg を腟内投与
その後は子宮内容物が排出されるまで3~4 時間ごとにミソプロストール400μg を腟内または舌下投与
《台湾》 低用量レジメンの研究が進行中
ミフェプリストン200㎎を内服の36+48時間後に
ミソプロストール400㎍を内服
《中国》 低用量レジメンの研究が進行中
ミフェプリストン100㎎を内服の24時間後に
ミソプロストール200㎍を舌下投与
https://obgyn.onlinelibrary.wiley.com/doi/10.1111/jog.13716
ミフェプリストン75㎎を内服の24時間後に
ミソプロストール400㎍を舌下投与
https://link.springer.com/article/10.1177/1933719116669055#Abs1
中絶薬の成功率と副作用
FDAの重大な有害事象 (2000年9月~2018年12月31日)では、24人の死亡(うち2例は子宮外妊娠)と数件の重症な感染症(致死性を含む)が報告されました。
また、中絶ではなく、流産治療の報告で、2020/8月にLancetに掲載された論文、2018/6月にNEJMに掲載された論文から上記のミフェプリストンとミソプロスロールの2つの薬を併用した治療のデータをお示しします(下に論文要約、全文を載せています)。なお、流産状態の処置(胎嚢/胎児への血流が消失した状況)よりも中絶(胎嚢/胎児への血流が豊富)である状態の処置の方が、治療成功率は低く、合併症が多くなることが考えられるため、参考値としてご覧ください。中絶薬の成功率は80%程度という良好な成績ではありますが、重大な症状がでた人もいたため、諸外国でも必ず医療機関で安全に治療を行う体制になっています。
《ミフェプリストン+ミソプロストール2剤併用治療での成績》
| Lancet 2020(英国) | NEJM2018(米国) | |
|---|---|---|
| 中絶薬1回分で不成功 | 17% 348人中 59人 | 16% 148人中 24人 |
| 中絶薬を追加で投与 | 14% 357人中 50人 | 5% 148人中 7人 |
| 手術が必要になった (緊急手術を含む) |
17% 355人中 62人 | 9% 148人中 13人 |
| 多量出血で輸血した | 3% 352人 中 11人 | 2% 148人中 3人 |
| 入院治療を要した 重症合併症(感染等) |
1% 357人中 5人 | 1% 148人中 2人 |
| 追加治療も含め全員が 治療完了するに要した日数 (中央値±標準偏差) |
27.0±14.2日 | no data |
《ミフェプリストン+ミソプロストール2剤併用治療での副作用報告》
| NEJM副作用の報告【149人中】 | |
|---|---|
| 副作用 | 人数 (%) |
| 倦怠感 | 118 (79.2) |
| 頭痛 | 88 (59.1) |
| めまい | 78 (52.1) |
| 寒感 | 68 (45.6) |
| 吐き気 | 56 (37.6) |
| 下痢 | 41 (27.5) |
| 嘔吐 | 40 (26.8) |
| 強い下腹部痛 | 20 (13.4) |
| 発熱 | 10 (6.7) |
要約:英国全土28病院の多施設共同研究で、稽留流産の治療薬のよりよいレシピを決定するための研究です。
MifeMiso試験と名付けられ、“無作為化二重盲検プラセボ対照試験”という結果に最もバイアスがかからない(結果の誘導がおきない)研究方法がとられています。
治療薬のレシピとして、ミフェプリストン+ミソプロストールの2剤を用いたもの(357人) VS ミソプロストールのみを使用したもの(354人)を対決し、投与後7日の時点で、どちらの方が流産治療の失敗率が低いかで決着をつけたものです。 結果はミフェプリストン+ミソプロストールの2剤を使用した方の勝ち、失敗数はミソプロストール単剤に比べて3割減でした。
もちろん成功率が高くても副作用が強いとレシピとしてイマイチなので、それもすべて検討して、副作用もなくはないけどミソプロストール単剤と変わらないとのことでした。
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31788-8/fulltext
要約:米国の複数の病院で、稽留流産の治療薬のよりよりレシピを決定するための研究です。ミフェプリストン+ミソプロストールの2剤を用いたもの(149人) VS1ミソプロストールのみを使用したもの(151人)を対決し、
投与後の1-4日後の治療成功率の高さで決着をつけたものです。結果は、ミフェプリストン+ミソプロストールの勝ち、成功数はミソプロストール単剤に比べて2.5割増しでした。
また副作用は2剤つかっても、1剤のみと変わらない結果でした。
厚生労働省 個人輸入規制薬
厚生労働省が個人輸入制限を行っている中絶薬
医師の適切な指導のもとに使用されなければ健康被害のおそれがある未承認の医薬品リスト【2020/8/31 最終改定】
| 販売元 | 一般名 | 原産国 |
|---|---|---|
| ミフェプレックス (Mifeprex) |
ミフェプリストン (RU:486 Mifepristone) |
米国 |
| ミフェジン (Mifegyne) |
ミフェプリストン (RU:486 Mifepristone) |
EU |
| 息隠 (米非司酉同片) |
ミフェプリストン (RU:486 Mifepristone) |
中国 |
| 保諾 (Apano) |
ミフェプリストン (RU:486 Mifepristone) |
台湾 |
| Miso-Kare Misoprostol Tablets IP200mcg |
ミソプロストール (Misoprostol) |
インド |
| A-Kare Combipack of Mifepristone Tablets IP & Misoprostol Tablets IP |
ミフェプリストン・ミソプロストール (Mifepristone & Misoprostol) |
インド |
| Misoprosto-200 | ミソプロストール (Misoprostol) |
インド |
※個人輸入し自己判断で使用するケースが続出し、この中絶法の欠点でもある不全流産となり出血が止まらずに病院に駆け込むという事案が報告されたため、日本産科婦人科学会や厚生労働省も問題視するようになり、2004年10月に厚生労働省は医師の処方箋又は指示書及び輸入報告書に基づき本人が行政機関の許可を得た場合を除く個人輸入の制限を決定した。当初の規制では、米国、EU、中国、台湾の製品は規制対象であったが、インド製は対象ではなかった。2018年度にインド製品輸入薬で救急搬送症例あり追加された。
https://www.mhlw.go.jp/stf/houdou/0000205985.html
2014年10月の中絶薬個人輸入を規制した際の厚生労働省資料

2020/09/24現在の厚生労働省ホームページでの呼びかけ
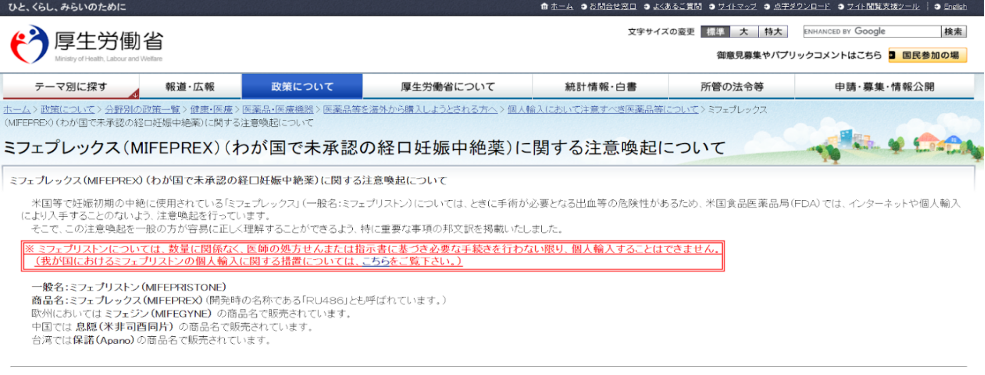
米国食品医薬品庁(FDA)の公表している資料の抜粋を掲載。医師のみが処方できる医薬品として規制され、個人輸入は危険との注意勧告されている。
- ミフェプレックスを使用した女性100人中5-8人程度が、中絶の完了または多量出血のため手術を要する。
- 卵管妊娠に気づかずに使用することで卵管破裂の危険がある。
- 医師による経過観察が受けられない人、服用後の2週間容体の急変時に速やかに医療機関に受診をすることが困難な人は使用すべきではない。
中絶薬に関するFDAの勧告
ミフェプレックス®(ミフェプリストン) に関する情報
ミフェプレックス®は、中絶薬ミソプロストールと一緒に使用され妊娠初期の流産や中絶の治療薬として使用される薬である。 FDAでは、ミフェプレックス®を2000年に新薬として承認した。2016年には、製薬会社からのデータに基づき中絶薬との補足使用を認めた。補足使用でのデータを検討した結果、ミフェプレックス®を中絶のために併用使用することは安全で有効であると判断した。
FDAが承認した治療方法 (2016)
ミフェプレックス®はミソプロストールとの併用療法として承認されている薬で、妊娠70日目(最終月経の開始日から70日以下)での流産または中絶の治療での使用が認められている。
使用方法は、
- 治療初日:200mgのミフェプレックス®を経口内服
- ミフェプレックス®服用の24〜48時間後:患者の希望の場所で、バッカル(頬袋)に800㎍のミソプロストールを服用
- ミフェプレックス®を服用の約7〜14日後:医師による診察
リスクの評価と軽減のための戦略(REMS)
FDAはミフェプレックス®に対するリスクの評価と軽減のための戦略(REMS)を適用した。当局は、ミフェプレックス®の安全な使用を確保するために継続的にREMSを行うことが必要と判断した。 この戦略に従い以下が定められている:
- ミフェプレックス®は、特定の資格を満たす医師、またはその監督下で、発注、処方、調剤される必要がある。
- ミフェプレックス®の処方を希望する医師は、注文および調剤する前に、処方者同意書に記入する必要がある。
- ミフェプレックス®は、認定された医師によって、またはその監督下で、診療所、診療所、および病院でのみで調剤することができる。
- 医師は、ミフェプレックス®を調剤する前に、署名された患者同意書が必要である。
- ミソプロストールを処方する医師は、FDAの規制の下で、ミソプロストール投薬ガイド(FDAが承認した患者向け情報)のコピーを患者に提供する必要がある。
ミフェプレックス® をインターネットで個人輸入しないこと!
薬剤を安全に使用し貴方の健康守るために策定された、重要な安全のための規制をすり抜けてしまうため、インターネット経由でミフェプレックス®を購入しないでください。
ミフェプレックス®には、患者様に提供する方法に特別な安全制限があります。 また、外国のインターネットから購入した医薬品は、FDAが承認したバージョンの医薬品ではなく、FDAが規制する製造管理や製造施設のFDA検査の対象ではありません。
ミフェプレックス®に対する質疑応答 (2019年4月12日更新)
1. ミフェプレックス®とは何ですか?どのように作用しますか?
ミフェプレックス®(ミフェプリストン)は、妊娠を継続するために必要なプロゲステロンと呼ばれるホルモンを遮断する薬です。 ミソプロストールは、ミソプロストールと呼ばれる別の薬と併用し、妊娠初期(最後の月経の初日から70日以内)の流産および中絶の治療に使用されます。
2. ミフェプレックス®のジェネリック版はありますか?
FDAは、2019年4月11日にGenBioPro、Inc社のジェネリック製剤を承認しました。この承認は、GenBioProの製品であるミフェプレックス錠200mgが、先発医薬品のミフェプレックス®と同等であるというFDAの決定を反映しています。先発薬品のミフェプレックス®と同様に、承認されたジェネリック製剤は妊娠70日までの子宮内妊娠の流産治療および中絶での適応があります。
3. ミフェプレックス®を服用してはいけない人は?
- 最終月経の開始日から70日以上経過した人
- 子宮外妊娠をしている人
- 副腎機能に異常がある人
- 長期のステロイド治療を受けている人
- 以前ミフェプリストンまたはミソプロストール、それらの類似薬でアレルギーがでた人
- 血が止まらない病気がある人や抗凝固薬(血液をサラサラにする薬)を使用している人
- 遺伝性ポルフィリン症の人
- 子宮内避妊具IUD挿入中の人(抜去してからミフェプレックス®を使用する)
4. 2016年3月29日にFDAがミフェプレックス®に対して追加した注意喚起事項は?
FDAは2000年にミフェプレックス®を承認し、2016年には中絶薬との補足使用も承認しました。この承認はミフェプレックス®の使用量や投与方法、治療レジメン、治療場所(自宅での投与を許可する)などが変更されました。またこの承認は、ミフェプレックス®が安全かつ効果的に使用できる妊娠週数や、投薬後の経過観察に関しても変更された。更には、適応症もFDAの基準を満たすように一新された。FDAは、REMS(リスクの評価と軽減のための戦略)に変更を加え、追加された適応症に対しても対応できるようにした。
5. ミフェプレックス®はどこで入手できますか?
ミフェプレックス®は医師または既定の基準を満たした専門家に直接供給されます。クリニックや病院のみで処方してもらうことが可能です。ドラッグストアでの購入やインターネット経由の購入は法律上認められていません。ジェネリック製剤に関しても同様です。
6. 医師がミフェプレックス®を入手調剤するには、どのような資格が必要ですか?
ミフェプリストンを処方する資格を取得する希望のある医師は、妊娠週数および子宮外妊娠を診断できる必要があります。また、必要時に流産手術を自身で(または他者に依頼して)施行できる必要があります。更には、緊急時に患者が適切な救急医療施設に受診できることを保証すること、及び患者同意書の署名の確認を行い、同意書のコピーと投薬説明書を各患者に提供することに責任をもつ必要があります。これらの特定の要綱を満たす医師は、ミフェプレックス®を発注し調剤する権限があります。一部の州では、医師以外の医療提供者が薬を処方することを許可しています。医療提供者は、個々の州法を確認する必要があります。
7. ミフェプレックス®の処方に制限はありますか?
FDAが 2000年に先発製剤のミフェプレックス®の新薬申請を承認した際、同薬剤が安全に使用されることを保証にするため、特定の処方制限が必要であると結論付けました。これらの制限は、2011年はREMSという戦略に移行しました。2016年には、ミフェプレックス®提供会社から提出された追加データと情報、安全に関する使用開始後データを考慮し、FDAはミフェプレックス®の安全な使用には引き続き特定の制限が必要であると結論付けました。REMSの戦略のもと、ミフェプレックス®は同薬剤の処方が許可され、特定の資格を満たす医師にのみ直接納品されます。また。診療所、病院などの特定の医療環境のみで調剤が可能で、ドラッグストアやインターネット上で入手することはできません。FDAは、インターネット経由での購入は、健康被害を防ぐために設定された安全監査から抜け落ちてしまうため、ミフェプレックス®およびその関連製剤を購入しないように警告しています。
8. ミフェプレックス®の起こりうる副作用は何ですか?
陣痛様の下腹部痛と経膣出血は治療の効果として生じることが考えられます。場合によっては、緊急手術によってしか治療しえない多量出血が起りえます。その他の一般的な副作用には、吐き気、脱力感、発熱/悪寒、嘔吐、頭痛、下痢、めまい(特に服用後1-2日目)が起りえます。また頻度は低いが起こる可能性がある副作用は、添付文書の副作用の欄に示しています。
9. ミフェプレックス®の使用で報告された重篤な有害事象には何がありますか?
FDAが新薬を承認後に重篤な有害事象の報告を受けることは珍しいことではありません。ミフェプレックス®服用による報告としては、2000年9月に承認後、2018年12月31日現在までで24人の死亡(うち2例は子宮外妊娠)および数件の重症な感染症(致死性を含む)が報告されています。これらの有害事象は、併用薬剤、併用治療、併用疾患の存在、また患者の申告した症状と実状の違いによる不適切な治療方針もあり、有害事象がミフェプレックス®の使用によると断定するものではありません。2018年12月31日までのデータを反映した有害事象の要約報告を別に示します。FDAはこれらを検討した上で、新たな安全指針の改定はなされませんでした。FDAは今後も、有害事象報告を1年毎+必要時に更新する予定です。FDAでは、承認された医薬品の有害事象に関する新しい情報を受け取り、確認し、医師と患者に最新情報を提供することも含めた必要な措置を講じ、安全に薬剤を使用できるよう努めています。
10. ミフェプレックス®を使用した患者の経過観察で医師が注意すべきことは何ですか?
中絶薬の使用に係わる医師や救急医を含め、中絶薬を使用中の患者が嘔気、嘔吐、下痢、倦怠感で来院した場合は腹痛を伴わなかったとしても敗血症の可能性を念頭におくべきです。これらの症状は、発熱がなくても、重症な感染症を示唆している可能性があります。採血を含めた検査での精査を強く推奨します。著名な左方偏位を伴う白血球増加や血液濃縮所見は敗血症を示唆する所見である可能性があります。
11. ミフェプレックス®を使用したことがある患者が今後妊娠をすることは可能ですか?
今回の妊娠中絶が完了した後から時間をあけることなく次の妊娠をすることが可能です。逆にすぐの妊娠を考えていない場合は、中絶終了直後から適切な避妊方法をとる必要があります。ご不明な点があれば、担当医にご相談ください。
12. ミフェプレックス®は他の国で承認されていますか?
ミフェプリストンによる中絶はフランスで1988年に承認され、英国、スウェーデンを含めた約60か国で承認されています。
13. ミフェプレックス®の値段はいくらですか?
米国において、FDAは薬剤の価格を決定する権限はもっていません。製薬会社、流通業者、小売業者が価格を設定しています。更に、FDAは私的保険会社が医薬品の費用を負担するかどうかに関与する権利をもっていません。私的保険の適用範囲は保険会社が決定権を持っています。
中絶薬が承認されている国
ニューヨーク州に本社がある“Gynuity健康プロジェクト”のデータより抜粋。
(https://gynuity.org/programs/medical-abortion)
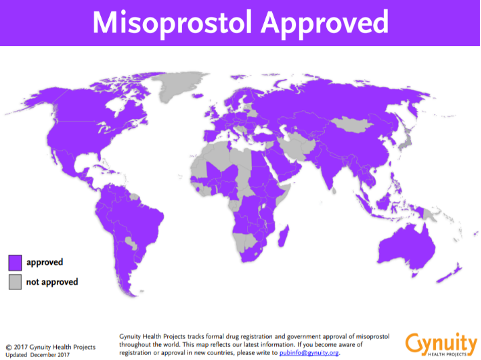
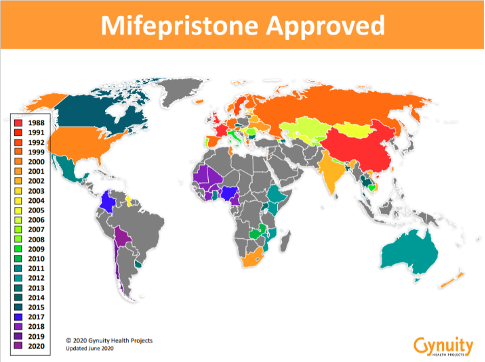
中絶薬承認に向けて~日本で行われた治験~
- ―現在結果解析中―
- 【概要】多施設共同非盲検第3相試験
- 【方法】ミフェプリストン200㎎を経口投与し、その36-48時間後にミソプロストール800㎍をバッカル投与する
- 【試験期間】2019/10/24-2020/06/30

